Sin embargo, en la molécula de amoniaco:
el átomo de nitrógeno posee un par de electrones libre que puede utilizar para enlazarse con otro átomo, ion o molécula. El enlace formado se conoce como Enlace Covalente Coordinado.
Reacciones de ácidos-bases de Lewis.
ESTRUCTURA ELECTRÓNICA DEL ÁTOMO
Note que la energía de los orbitales en el nivel 4 es:
sin embargo,
La energía de los orbitales se ve influenciada por la carga nuclear del átomo y por la naturaleza y número de los otros electrones en el átomo. De esta manera los orbitales 3d del potasio tienen mayor energía que el 4s, para el escandio tienen energía comparable; mientras que para el cinc el orbital 4s es de mayor energía que el 3d.
Los electrones se acomodan en los orbitales de acuerdo a la REGLA DE HUND. Dos factores controlan la energía de un orbital para la mayoría de los átomos: el tamaño y la forma del orbital, según se muestra en la siguiente figura:
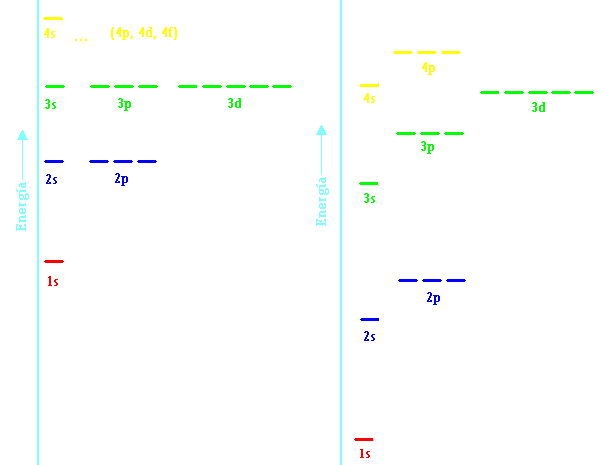

Diagrama empleado para determinar el llenado de los orbitales