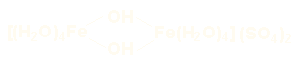
sulfato de µ-dihidroxobis(tetraacuahierro(III))
nitrato de µ-amido-µ-hidroxobis(tetraamíncobalto(III))
PtCl2 + 4NH3----> PtCl24NH3
Es difícil saber cuando se descubrió el primer complejo metálico. Quizá se trata el azul de prusia KCNFe(CN)2Fe(CN)3, obtenido a principios del siglo XVIII. Sin embargo, la fecha que está registrada es 1798, cuando Tassaert descubrió el cloruro de hexaamíncobalto(III) CoCl36NH3. Las observaciones de Tassaert no se podían explicar mediante la teoría química de esa época.
| Complejo | Nombre | Formulación Actual |
|---|---|---|
| Cr(SCN)3NH4SCN·2NH3 | Sal de Reinecke | NH4[Cr(NCS)4(NH3)2] |
| 2PtCl2·2NH3 | Sal verde de Magnus | [Pt(NH3)4][PtCl4] |
| Co(NO2)3 ·KNO2·2NH3 | Sal de Erdmann | K[Co(NO2)4(NH3)2] |
| PtCl2·KCl·C2H4 | Sal de Zeise | K[PtCl3(C2H4)] |
| CoCl3·6NH3 Amarillo | Cloruro luteocobáltico | [Co(NH3)6]Cl3 |
| CoCl3·5NH3 Morado | Cloruro purpurocobáltico | [CoCl(NH3)5]Cl2 |
| CoCl3·4NH3 Verde | Cloruro praseocobáltico | trans-[CoCl2(NH3)4]Cl |
| CoCl3·4NH3 Violeta | Cloruro violeocobáltico | cis-[CoCl2(NH3)4]Cl |
| CoCl3·5NH3·H2O Rojo | Cloruro roseocobáltico | [Co(NH3)5H2O]Cl3 |
La preparación de los complejos metálicos generalmente implica la reacción de una sal y alguna otra molécula o ion. Se ha hecho mucho trabajo con amoniaco. Inicialmente el nombre que se daba a los compuestos era el de la persona que los había preparado.
Jørgensen intentó formular estos compuestos en forma análoga a los compuestos orgánicos:
Fue posible nombrar sistemáticamente a los compuestos de coordinación una vez que Werner descubrió que podían ser sales o compuestos neutros.
Las sales se designan en la forma común utilizando un nombre de dos palabras y a los compuestos neutros se les da nombre de una palabra. Por ejemplo:
Los ligantes neutros reciben el mismo nombre que su molécula, los ligantes negativos tienen la terminación "o" y, los ligantes positivos (que son poco comunes) tienen la terminación "io".
Los ligantes en un complejo se enlistan en orden alfabético:
Se usan los prefijos di-, tri-, tetra-, etc., antes de los nombres de los ligantes simples tales como bromo, nitro y oxalato; los prefijos bis-, tris-, tetraquis-, pentaquis-, etc., se usan antes de nombres complejos como etilendiamina y trialquilfosfina.
K3[Al(C2O4)3] trisoxoaluminato(III) de potasio
[CoCl2 (en) 2]SO4 sulfato de diclorobis(etilendiamina)cobalto(III)
La terminación del metal en los complejos aniónicos es ato. En los compuestos catiónicos o neutros el nombre del metal se utiliza sin ninguna terminación característica.
Los estados de oxidación del átomo central se designan mediante un número romano que se escribe entre paréntesis después del nombre del metal, sin espacio entre los dos. Para un estado de oxidación negativo se emplea un signo de menos antes del número romano, y 0 para estado de oxidación cero.
Na[Co(CO) 4] tetracarbonilcobaltato(-I) de sodio
K4 [Ni(CN) 4] tetracianoniquelato(0) de potasio
El nombre de los ligantes que unen dos centros de coordinación va precedido por la letra griega µ, que se repite antes del nombre de cada ligante puente.

sulfato de µ-dihidroxobis(tetraacuahierro(III))

nitrato de µ-amido-µ-hidroxobis(tetraamíncobalto(III))
Cuando sea necesario, se puede designar el átomo de enlace de un ligante colocando el símbolo del elemento que está directamente unido, después del nombre del grupo (en letras cursivas), separada por un guión.
para el tiocianato, nitrito y cianuro, se pueden utilizar los siguientes nombres: -SCN tiocianato -NO2 nitro -CN ciano -NCS isotiocianato -ONO nitrito -NC isociano
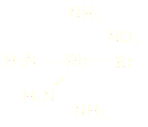
ion cis-tetraamíniodobromorodio(III)
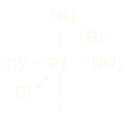
1-amín-2-bromo-4-cloro-6-iodonitro-(piridina)platino(IV)
Si una solución rota el plano de luz polarizada amarilla (línea de del sodio) a la derecha, el soluto se designa como el isómero (+), si lo rota a la izquierda, es un isómero (-).
(+) K3 [Ir(C2O4)3] (+)trisoxalatoiridato(III) de potasio
(-) [Cr(en) 3]Cl3 cloruro de (-)tris(etilendiamina)cromo(III)